NF EN 1041+A1
Informations fournies par le fabricant de dispositifs médicaux
Le présent document spécifie les exigences concernant les informations à fournir par un fabricant de dispositifs médicaux d'après la réglementation dictée par la Directive du Conseil 90/385/CE relative aux dispositifs médicaux implantables actifs et par la Directive du Conseil 93/42/CE concernant les dispositifs médicaux. Il ne spécifie pas la langue à utiliser pour ces informations ni les moyens par lesquels les informations sont fournies. Il a également pour but de venir compléter les exigences spécifiques des Directives UE sur les dispositifs médicaux citées en donnant des indications sur la manière dont certaines exigences peuvent être satisfaites. Si un fabricant suit ces indications, celles-ci laissent à présumer de la conformité aux exigences essentielles relatives à la fourniture d'informations.
Le présent document spécifie les exigences concernant les informations à fournir par un fabricant de dispositifs médicaux d'après la réglementation dictée par la Directive du Conseil 90/385/CE relative aux dispositifs médicaux implantables actifs et par la Directive du Conseil 93/42/CE concernant les dispositifs médicaux. Il ne spécifie pas la langue à utiliser pour ces informations ni les moyens par lesquels les informations sont fournies. Il a également pour but de venir compléter les exigences spécifiques des Directives UE sur les dispositifs médicaux citées en donnant des indications sur la manière dont certaines exigences peuvent être satisfaites. Si un fabricant suit ces indications, celles-ci laissent à présumer de la conformité aux exigences essentielles relatives à la fourniture d'informations.
Le présent document spécifie les exigences concernant les informations à fournir par un fabricant de dispositifs médicaux d'après la réglementation dictée par la Directive du Conseil 90/385/CEE relative aux dispositifs médicaux implantables actifs et par la Directive du Conseil 93/42/CEE concernant les dispositifs médicaux. Il ne spécifie pas la langue à utiliser pour ces informations ni les moyens par lesquels les informations sont fournies. Il a également pour but de venir compléter les exigences spécifiques des Directives UE sur les dispositifs médicaux citées en donnant des indications sur la manière dont certaines exigences peuvent être satisfaites. Si un fabricant suit ces indications, celles-ci laissent à présumer de la conformité aux exigences essentielles relatives à la fourniture d'informations. Le présent document ne couvre pas les exigences concernant la fourniture d'informations pour les dispositifs médicaux de diagnostic in vitro qui font l'objet d'autres normes d'étiquetage. Lorsque des transpositions nationales des directives précisent les moyens par lesquels les informations doivent être fournies, le présent document ne propose pas de dérogation à ces exigences pour un pays particulier.
NOTE 1 Il y a des indications ou une justification pour cet Article figurant dans l'Article A.2. Le présent document spécifie les exigences relatives aux informations fournies par le fabricant pour un dispositif médical ou un accessoire, tel que défini en 3.1. Le présent document contient les exigences génériques communes concernant l’identification et l’étiquetage d’un dispositif médical ou d’un accessoire, l'emballage, le marquage d’un dispositif médical ou d’un accessoire et les informations d’accompagnement. Le présent document ne spécifie pas le mode de transmission des informations. NOTE 2 Certaines autorités compétentes imposent des exigences différentes concernant l’identification, le marquage et la documentation d’un dispositif médical ou d’un accessoire. Les exigences spécifiques des normes de produit relatives à un dispositif médical ou des normes de groupe prévalent sur les exigences du présent document.
- Avant-propos3
- Introduction4
-
1 Domaine d'application4
-
2 Références normatives4
-
3 Termes et définitions5
-
4 Exigences6
-
4.1 Généralités6
-
4.2 Unités, symboles et couleurs6
-
4.3 Langue et identifiants de pays6
-
4.4 Dates6
-
4.5 Nomenclature des dispositifs6
-
5 Exigences relatives aux informations devant être fournies7
-
5.1 Généralités7
-
5.2 Exigences spécifiques7
-
6 Documentation8
- Annexe A (informative) Exigences et recommandations concernant les Directives 93/42/CEE et 90/385/CEE, amendées9
-
A.1 Exigences et recommandations relatives aux dispositifs médicaux (Directive 93/42/CEE)9
-
A.2 Exigences et recommandations relatives aux dispositifs médicaux implantables actifs (Directive 90/385/CEE)15
- Annexe B (informative) Recommandations relatives à l'étiquetage alternatif de la notice d'utilisation19
-
B.1 Recommandations relatives à l'étiquetage alternatif des dispositifs médicaux (Directive 93/42/CEE) .20
-
B.2 Recommandations relatives à l'étiquetage alternatif des dispositifs médicaux implantables actifs (Directive 90/385/CEE)21
- Annexe ZA (informative) Relations entre la présente Norme européenne et les exigences essentielles de la Directive UE 93/42/CE22
- Annexe ZB (informative) Relations entre la présente Norme européenne et les exigences essentielles de la Directive UE 90/385/CE23
- Bibliographie24
Le service Exigences vous aide à repérer rapidement au sein du texte normatif :
- les clauses impératives à satisfaire,
- les clauses non indispensables mais utiles à connaitre, telles que les permissions et les recommandations.
L’identification de ces types de clauses repose sur le document « Directives ISO/IEC, Partie 2 - Principes et règles de structure et de rédaction des documents ISO » ainsi que sur une liste de formes verbales constamment enrichie.
Avec Exigences, accédez rapidement à l’essentiel du texte normatif !
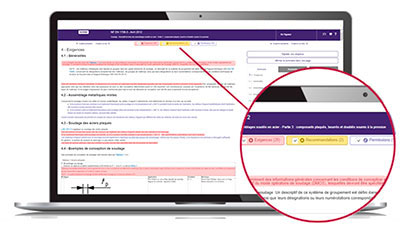
D’un simple coup d’oeil, vous pourrez identifier les ajouts, suppressions ou modifications à un texte, tableau, figure et formule.
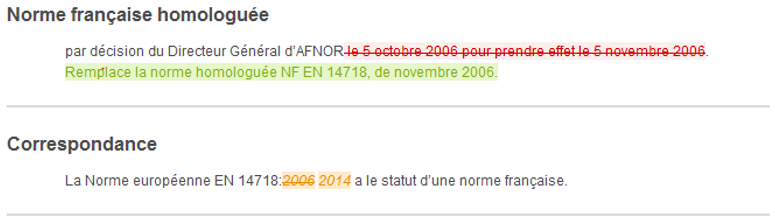
Le service Redlines+ vous est proposé sur la collection des normes françaises en vigueur, en langue Française et au format HTML et PDF.
Pour un aperçu du service, veuillez cliquer sur Visualiser une norme au format redline
- D'un simple clic ajoutez une nouvelle langue, le service Exigences ou Redline+ et ajouter un ou plusieurs utilisateur(s) supplémentaire(s).
- Que vous soyez en cours d'acquisition d'une norme ou qu'elle soit déjà disponible dans votre espace personnel, le service UPSELL est disponible à chaque étape pour vous aider à sa compréhension et dans la mise en place au sein de votre structure.
COBAZ est la solution simple et efficace pour répondre aux besoins normatifs liés à votre activité, en France comme à l’étranger.
Disponible sur abonnement, CObaz est LA solution modulaire à composer selon vos besoins d’aujourd’hui et de demain. Découvrez vite CObaz !
Demandez votre démo live gratuite, sans engagement
Je découvre COBAZ