NF EN 1041+A1
Information supplied by the manufacturer of medical devices
Le présent document spécifie les exigences concernant les informations à fournir par un fabricant de dispositifs médicaux d'après la réglementation dictée par la Directive du Conseil 90/385/CE relative aux dispositifs médicaux implantables actifs et par la Directive du Conseil 93/42/CE concernant les dispositifs médicaux. Il ne spécifie pas la langue à utiliser pour ces informations ni les moyens par lesquels les informations sont fournies. Il a également pour but de venir compléter les exigences spécifiques des Directives UE sur les dispositifs médicaux citées en donnant des indications sur la manière dont certaines exigences peuvent être satisfaites. Si un fabricant suit ces indications, celles-ci laissent à présumer de la conformité aux exigences essentielles relatives à la fourniture d'informations.
Le présent document spécifie les exigences concernant les informations à fournir par un fabricant de dispositifs médicaux d'après la réglementation dictée par la Directive du Conseil 90/385/CE relative aux dispositifs médicaux implantables actifs et par la Directive du Conseil 93/42/CE concernant les dispositifs médicaux. Il ne spécifie pas la langue à utiliser pour ces informations ni les moyens par lesquels les informations sont fournies. Il a également pour but de venir compléter les exigences spécifiques des Directives UE sur les dispositifs médicaux citées en donnant des indications sur la manière dont certaines exigences peuvent être satisfaites. Si un fabricant suit ces indications, celles-ci laissent à présumer de la conformité aux exigences essentielles relatives à la fourniture d'informations.
Le présent document spécifie les exigences concernant les informations à fournir par un fabricant de dispositifs médicaux d'après la réglementation dictée par la Directive du Conseil 90/385/CEE relative aux dispositifs médicaux implantables actifs et par la Directive du Conseil 93/42/CEE concernant les dispositifs médicaux. Il ne spécifie pas la langue à utiliser pour ces informations ni les moyens par lesquels les informations sont fournies. Il a également pour but de venir compléter les exigences spécifiques des Directives UE sur les dispositifs médicaux citées en donnant des indications sur la manière dont certaines exigences peuvent être satisfaites. Si un fabricant suit ces indications, celles-ci laissent à présumer de la conformité aux exigences essentielles relatives à la fourniture d'informations. Le présent document ne couvre pas les exigences concernant la fourniture d'informations pour les dispositifs médicaux de diagnostic in vitro qui font l'objet d'autres normes d'étiquetage. Lorsque des transpositions nationales des directives précisent les moyens par lesquels les informations doivent être fournies, le présent document ne propose pas de dérogation à ces exigences pour un pays particulier.
NOTE 1 There is guidance or rationale for this Clause contained in Clause A.2. This document specifies the requirements for information supplied by the manufacturer for a medical device or by the manufacturer for an accessory, as defined in 3.1. This document includes the generally applicable requirements for identification and labels on a medical device or accessory, the packaging, marking of a medical device or accessory, and accompanying information. This document does not specify the means by which the information is to be supplied. NOTE 2 Some authorities having jurisdiction impose different requirements for the identification, marking and documentation of a medical device or accessory. Specific requirements of medical device product standards or group standards take precedence over requirements of this document.
- Avant-propos3
- Introduction4
-
1 Domaine d'application4
-
2 Références normatives4
-
3 Termes et définitions5
-
4 Exigences6
-
4.1 Généralités6
-
4.2 Unités, symboles et couleurs6
-
4.3 Langue et identifiants de pays6
-
4.4 Dates6
-
4.5 Nomenclature des dispositifs6
-
5 Exigences relatives aux informations devant être fournies7
-
5.1 Généralités7
-
5.2 Exigences spécifiques7
-
6 Documentation8
- Annexe A (informative) Exigences et recommandations concernant les Directives 93/42/CEE et 90/385/CEE, amendées9
-
A.1 Exigences et recommandations relatives aux dispositifs médicaux (Directive 93/42/CEE)9
-
A.2 Exigences et recommandations relatives aux dispositifs médicaux implantables actifs (Directive 90/385/CEE)15
- Annexe B (informative) Recommandations relatives à l'étiquetage alternatif de la notice d'utilisation19
-
B.1 Recommandations relatives à l'étiquetage alternatif des dispositifs médicaux (Directive 93/42/CEE) .20
-
B.2 Recommandations relatives à l'étiquetage alternatif des dispositifs médicaux implantables actifs (Directive 90/385/CEE)21
- Annexe ZA (informative) Relations entre la présente Norme européenne et les exigences essentielles de la Directive UE 93/42/CE22
- Annexe ZB (informative) Relations entre la présente Norme européenne et les exigences essentielles de la Directive UE 90/385/CE23
- Bibliographie24
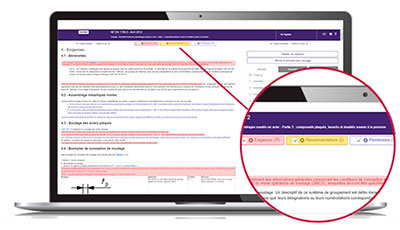
The Requirements department helps you quickly locate within the normative text:
- mandatory clauses to satisfy,
- non-essential but useful clauses to know, such as permissions and recommendations.
The identification of these types of clauses is based on the document “ISO / IEC Directives, Part 2 - Principles and rules of structure and drafting of ISO documents ”as well as on a constantly enriched list of verbal forms.
With Requirements, quickly access the main part of the normative text!
At a glance, you will be able to identify the additions, deletions or modifications to a text, table, figure and formula.
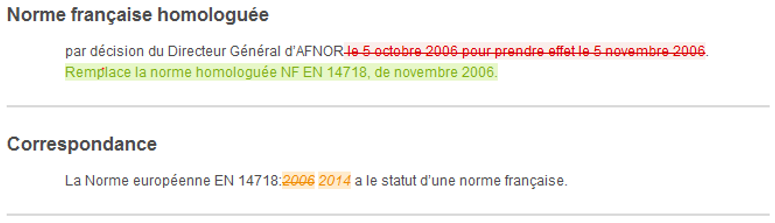
The Redlines + service is offered to you on the collection of French standards in force, in French language and in HTML and PDF format.
For an overview of the service, click on View a standard in redline format
- With a single click, add a new language, the Requirements or Redline+ service and add one or more additional users.
- Whether you are in the process of acquiring a standard or it is already available in your personal space, the UPSELL service is available at every stage to help you understand it and implement it within your organization.
COBAZ is the simple and effective solution to meet the normative needs related to your activity, in France and abroad.
Available by subscription, CObaz is THE modular solution to compose according to your needs today and tomorrow. Quickly discover CObaz!
Request your free, no-obligation live demo
I discover COBAZ